Recherche translationnelle en santé,
technologie pour la santé et recherche clinique
- > Nos équipes de recherche / 3D CHIP
- > 3D CHIP / Axe 1 : La bio impression 3D de mini-cerveaux
- > 3D CHIP
Travaille sur
- > 23- The Optic Nerve at Stake: Update on Environmental Factors Modulating Expression of Leber’s Hereditary Optic Neuropathy.Biomedicines. 2024 Mar 6;12(3):584. doi: 10.3390/biomedicines12030584.
Layrolle P, Orssaud C, Leleu M, Payoux P, Chavanas S.
- > 87- Message in a Scaffold: Natural Biomaterials for Three-Dimensional (3D) Bioprinting of Human Brain Organoids.Biomolecules. 2022 Dec 22;13(1):25. doi: 10.3390/biom13010025.
Layrolle P, Payoux P, Chavanas S.
- > 57- PPAR Gamma and Viral Infections of the BrainInt J Mol Sci. 2021 Aug; 22(16): 8876 doi: 10.3390/ijms22168876
Pierre Layrolle, Pierre Payoux, and Stéphane Chavanas
- > 36- Bacteria-derived long chain fatty acid exhibits anti-inflammatory properties in colitis.Gut. 2021 Jun;70(6):1088-1097. doi: 10.1136/gutjnl-2020-321173.
Pujo J, Petitfils C, Le Faouder P, Eeckhaut V, Payros G, Maurel S, Perez-Berezo T, Van Hul M, Barreau F, Blanpied C, Chavanas S, Van Immerseel F, Bertrand-Michel J, Oswald E, Knauf C, Dietrich G, Cani PD, Cenac N.
- > 35- Human cytomegalovirus infection is associated with increased expression of the lissencephaly gene PAFAH1B1 encoding LIS1 in neural stem cells and congenitally infected brains.J Pathol. 2021 May;254(1):92-102. doi: 10.1002/path.5640. Epub 2021 Mar 24.
Rolland M, Martin H, Bergamelli M, Sellier Y, Bessières B, Aziza J, Benchoua A, Leruez-Ville M, Gonzalez-Dunia D, Chavanas S.
Publications rédigées ou co-rédigées
Les recherches de Stéphane Chavanas sont orientées vers la modélisation pathologique et la physiopathologie des maladies humaines.
Travaux antérieurs
A l’unité INSERM U385 à Nice, puis au Wellcome Trust Centre for Human Genetics à Oxford, Stéphane Chavanas a étudié la biologie et la physiopathologie de l’épiderme, et caractérisé des mutations génétiques causatives de maladies cutanées sévères, et notamment celles du gène SPINK5 qu’il a découvert (par exemple :*1–*4 (voir références)).
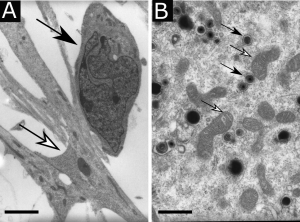
FIGURE 1 : Microscopie électronique à transmission montrant (A) une cellule souche neurale humaine (flèche blanche) au contact d’un neurone immature (flèche noire), barre d’échelle : 5 µm, ou (B) des particules virales de cytomégalovirus (flèches blanches) dans le cytoplasme d’une cellule souche neurale humaine au voisinage des mitochondries (flèches noires), barre d’échelle : 0,5 µm.
Au Centre de Toulouse Purpan (désormais Infinity, Institut Toulousain des Maladies Infectieuses et Inflammatoires), Stéphane Chavanas a étudié la physiopathologie de l’infection congénitale à cytomégalovirus humain, qui est la cause la plus fréquente d’anomalies congénitales du système nerveux central. En collaboration avec l’Institut des Cellules Souches ISTEM (Corbeil-Essonnes), Stéphane Chavanas a développé un modèle in vitro d’infection des progéniteurs neuraux par le HCMV avec des cellules souches neurales dérivées de cellules souches embryonnaires humaines (figure 1). Les études du groupe de Stéphane Chavanas ont ainsi fait progresser la connaissance des mécanismes moléculaires et cellulaires à l’origine des séquelles de l’infection dans le placenta *5 et dans le cerveau du fœtus *6,*7.
Organoïdes cérébraux humains
La production d’organoïdes cérébraux à partir de cellules pluripotentes humaines, réussie pour la première fois en 2013 par M. Lancaster et J. Knoblich, fut une étape clé pour la modélisation du cerveau humain sain ou pathologique. Au cours de leur maturation, ces organoïdes, qui se cultivent en suspension, conduisent à la formation de structures rappelant les structures cérébrales et à la différenciation des progéniteurs en une variété de types cellulaires neuronaux ou gliaux. Néanmoins, ils ne reproduisent pas fidèlement l’anatomie du cerveau, posent des problèmes de reproductibilité et d’apport en nutriments et en oxygène à toutes les populations cellulaires. Au sein de la nouvelle équipe 3D Chip, nous développerons un modèle original d’organoïde cérébral humain par bio-impression 3D.
Nous utiliserons des cellules souches neurales humaines (NSC) dérivées de cellules embryonnaires souches (Fig. 2 et 3). Nous utiliserons aussi des NSC génétiquement modifiées ou produites à partir d’IPSC (cellules pluripotentes induites) pour modéliser des maladies du système nerveux central (autisme, maladies neurodégénératives…) Les cellules seront encapsulées dans des hydrogels pour en optimiser la prolifération et la différenciation. La technologie de bio-impression 3D nous apportera précision, reproductibilité, et flexibilité. Ces modèles pourraient reproduire la diversité et l’organisation du cerveau au niveau cellulaire (progéniteurs, neurones, macroglie et microglie…) Ils seront caractérisés par microscopie avec des marqueurs spécifiques, par électrophysiologie et par imagerie à résonance magnétique. Nos modèles présenteront un potentiel fort pour la modélisation pathologique et des études de physiopathologie ou pour le criblage d’actifs pharmaceutiques.
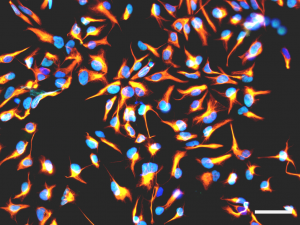
FIGURE 2 : Analyse par immunofluorescence montrant des cellules souches neurales humaines en culture exprimant la nestine (orange) ou SOX2 (cyan). Les noyaux sont contre-colorés avec du DAPÏ (bleu). Barre d’échelle : 50 µm.
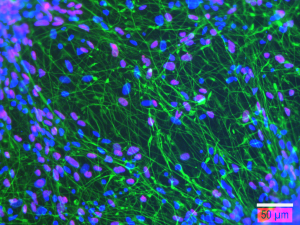
FIGURE 3 : Analyse par immunofluorescence montrant des neurones dérivés de cellules souches neurales humaines après 21 jours de différenciation in vitro, exprimant la beta 3 tubuline (vert), ou HUC/D (magenta). Les noyaux sont contre-colorés avec du DAPÏ (bleu). Barre d’échelle : 50 µm.
Références
*1 : Chavanas, S. et al. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome. Nat. Genet. 25, (2000).
*2 : Walley, A. J. et al. Gene polymorphism in Netherton and common atopic disease. Nat. Genet. 29, (2001).
*3 : Chavanas, S. et al. A homozygous nonsense mutation in the PLEC1 gene in patients with epidermolysis bullosa simplex with muscular dystrophy. J. Clin. Invest. 98, (1996).
*4 : Chavanas, S. et al. Splicing modulation of integrin ?4 pre-mRNA carrying a branch point mutation underlies epidermolysis bullosa with pyloric atresia undergoing spontaneous amelioration with ageing. Hum. Mol. Genet. 8, (1999).
*5 : Leghmar, K. et al. Cytomegalovirus Infection Triggers the Secretion of the PPARgamma Agonists 15-Hydroxyeicosatetraenoic Acid (15-HETE) and 13-Hydroxyoctadecadienoic Acid (13-HODE) in Human Cytotrophoblasts and Placental Cultures. PLoS One 10, e0132627 (2015).
*6 : Rolland, M. et al. PPARγ Is Activated during Congenital Cytomegalovirus Infection and Inhibits Neuronogenesis from Human Neural Stem Cells. PLoS Pathog. 12, e1005547 (2016).
*7 : Rolland, M. et al. Human cytomegalovirus infection is associated with increased expression of the lissencephaly gene PAFAH1B1 encoding LIS1 in neural stem cells and congenitally infected brains. J. Path. 254:92-102 (2021)

