Recherche translationnelle en santé,
technologie pour la santé et recherche clinique
iDREAM / Axe 1 : Imagerie de la réparation cérébrale motrice
Médecine régénérative: Implants cérébraux et thérapie cellulaire
L’axe est coordonné par Isabelle Loubinoux et Franck Desmoulin.
Objectifs scientifiques
Nous développons des thérapies qui s’adressent aux patients avec de lourds handicaps (AVC, Traumatisme crânien grâve).
Notre approche se base sur la régénération de la lésion cérébrale avec des implants et/ou des greffe de cellules.
L’imagerie IRM est un outil crucial pour effectuer un suivi longitudinal afin d’appréhender l’intégration des implants ou des cellules dans le cerveau, leur vascularisation, la dégradation des biomatériaux, leur innocuité, et leur sécurité, ainsi que la détection d’événements indésirables.
Les implants régénératifs
L’implant en silicone fonctionnalisé
La médecine régénérative apporte de nouveaux espoirs de traitement qui résident sur des neuro-implants (thérapie cellulaire sur biomatériaux) afin de rétablir des pontages longue-distance des aires cérébrales. L’équipe a fait la preuve de concept de neuro-implants améliorant la performance motrice chez le rongeur. La sécurité est démontrée chez le primate non-humain (marmouset).
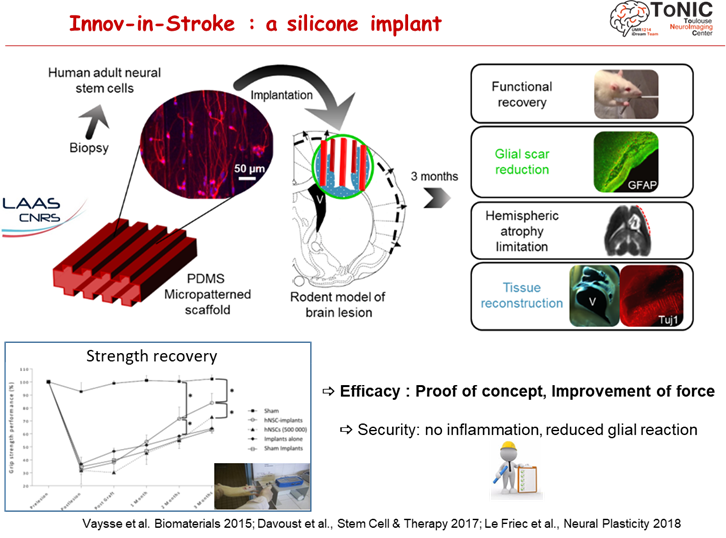
Un essai clinique de sécurité des implants est en préparation: projet FAVOUR (ANR Médécine Régénérative et programme Messidore) sur des patients traumatisés crâniens graves.
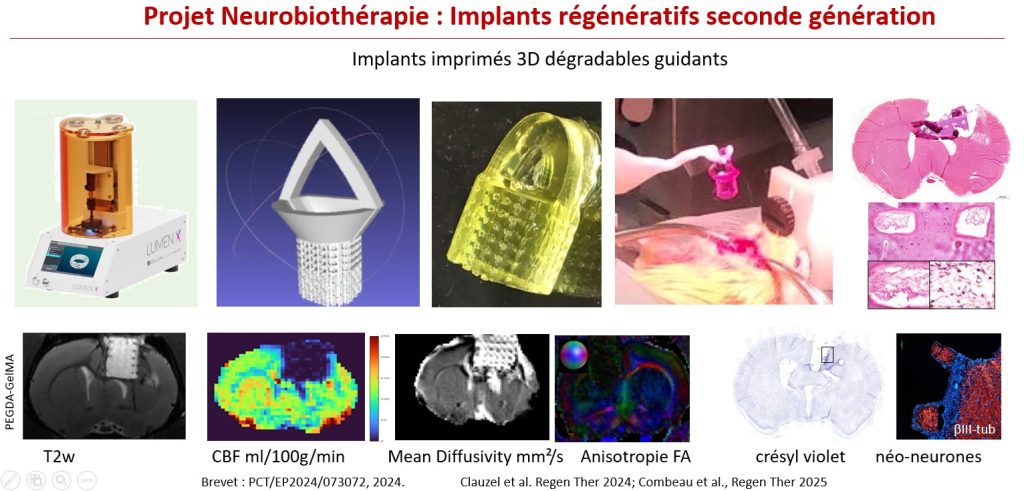
L’implant imprimé 3D dégradable
La seconde génération d’implants cérébraux régénératifs se focalise sur des implants dégradables. L’impression 3D leur confère une architecture complexe mimant le cortex cérébral en six couches interconnectées. L’imagerie T2 offre une bonne visualisation de l’hydrogel et de sa dégradation au cours du temps. L’imagerie de perfusion pCASL permet de suivre la revascularisation de l’implant. L’imagerie de tenseur de diffusion mesure la diffusivité de l’eau dans le matériau, les pores et le tissu (Projet Matrix, financement ANR ASTRID).
La thérapie cellulaire
La greffe intranasale de cellules gliales entériques
La proximité des cellules nerveuses entériques avec les cellules cérébrales pourrait en faire une source de suppléance pour le cerveau (Colitti et al. Adv Sci 2026).
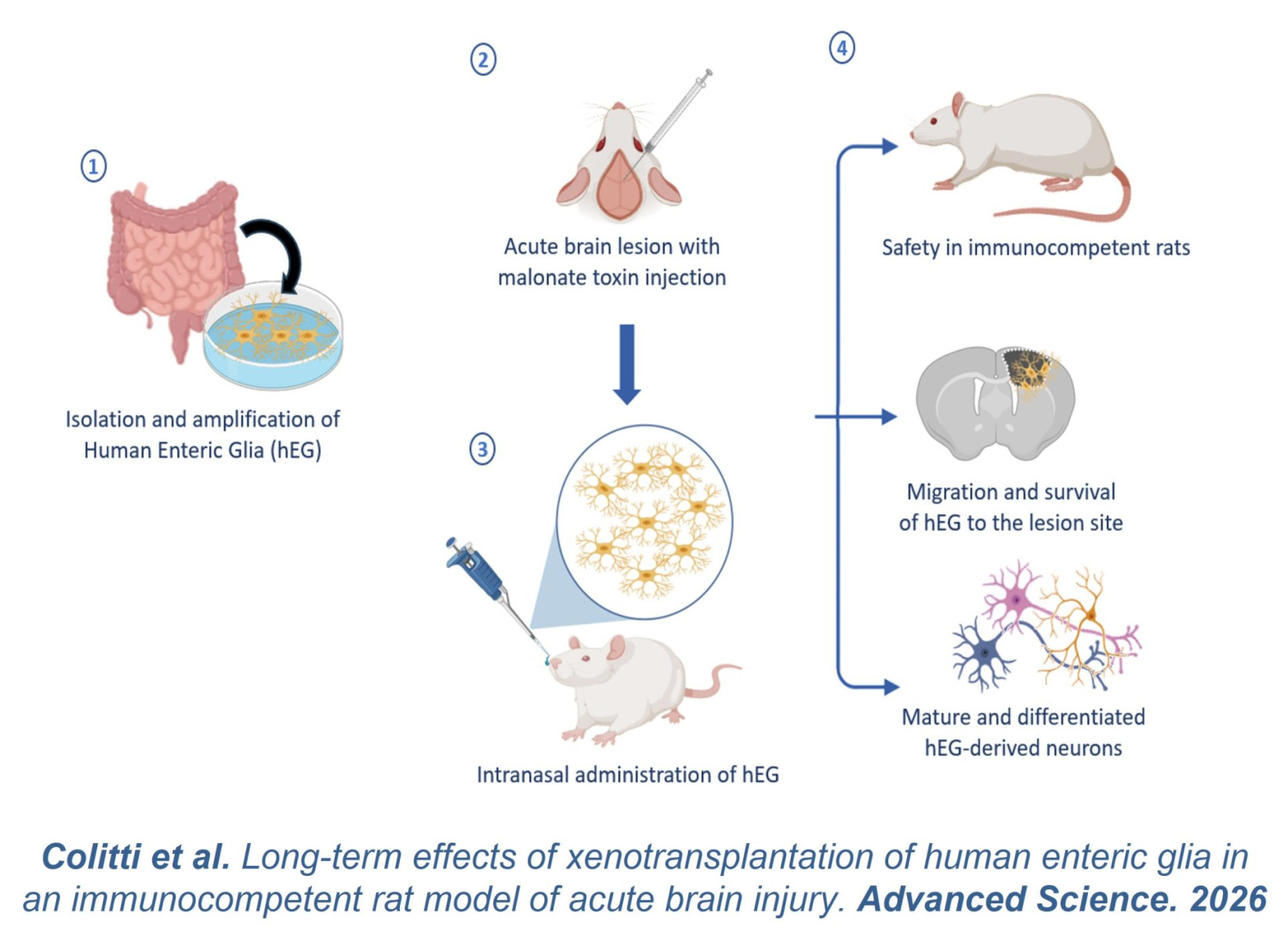
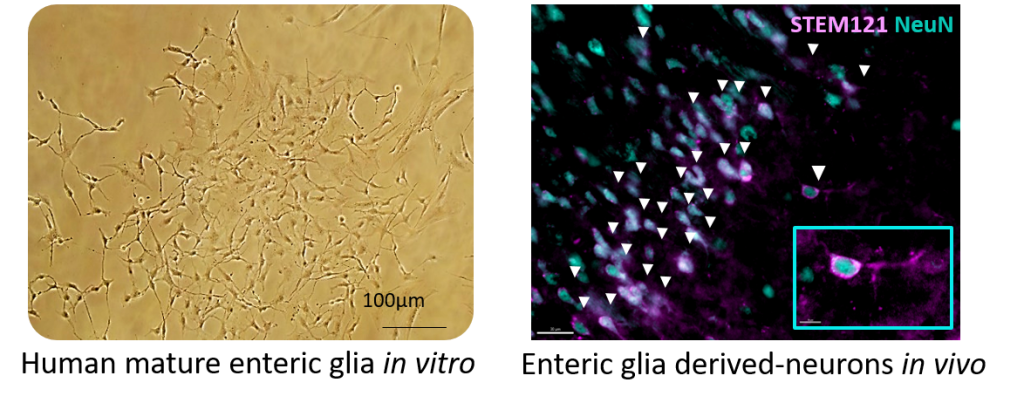
Des cellules gliales entériques humaines ont été greffées par voie intranasale dans des cerveaux de rats et se sont préférentiellement différentiées en neurones (Colitti et al. Adv Sci 2026).
L’imagerie préclinique
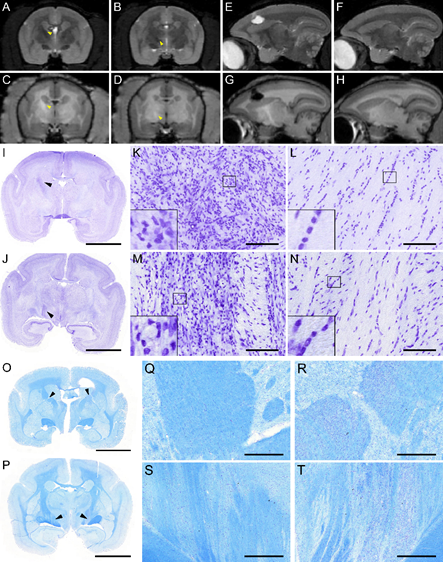
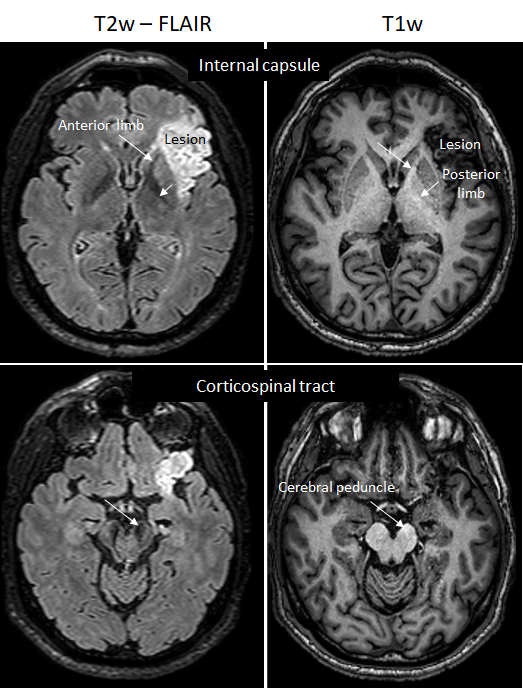
Biomarqueur de dégénérescence secondaire
Nous avons découvert un nouveau biomarqueur de la gliose accompagnant la dégénérescence axonale chez le patient AVC et le primate non-humain cérébrolésé (marmouset). Plusieurs mois après la lésion corticale, le faisceau corticospinal subit une perte de myéline, une infiltration astrocytaire et une réaction microgliale. Elles induisent une perte d’intensité sur les IRM T2 et une légère hyperintensité sur les IRM T1 (Le Friec et al., Trans Stroke Res 2020).
Mise en évidence de la dégénérescence du faisceau corticospinal
Ouverture de la barrière hémato-encéphalique
Notre cerveau est protégé par la barrière hémato-encéphalique. Mais certains médicaments ne peuvent la traverser.
L’imagerie préclinique permet de mettre au point des procédures d’ouverture temporaire de la barrière hématoencéphalique et de déterminer les conditions sécuritaires.
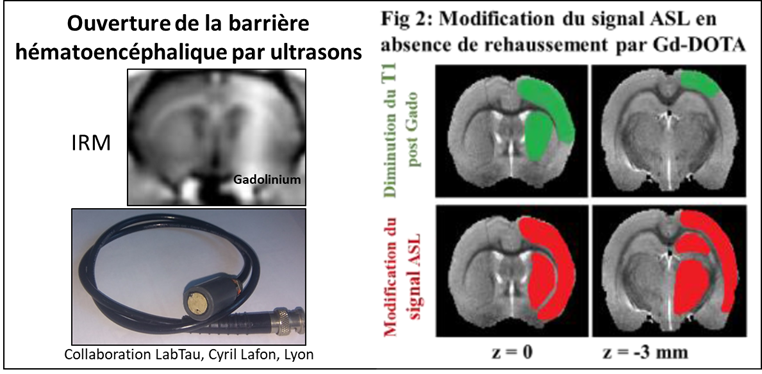
(Labriji et al. Magnetic Resonance in Medecine, 2023)