Recherche translationnelle en santé,
technologie pour la santé et recherche clinique
iDREAM / Axe 2 | 🚧 : Adaptation et réadaptation motrices

L’axe Neuro-biomécanique évolue !!!
Dans le cadre des campagnes 2025-2026 d’évaluation par l’HCERES et de renouvellement des Unités de Recherche par l’Inserm, l’Axe 3 – Neuro-biomécanique – NeuroBiomeK de l’équipe iDREAM devient l’Axe 2 – Adaptation et Réadaptation, après entrainement, lésion cérébrale ou dysfonction coordonné par Evelyne BLOCH-GALLEGO et Jessica TALLET.
Notre page est en cours d’actualisation. En attendant, vous retrouverez ci-dessous toutes les informations concernant l’axe NeuroBiomeK…


Neuro-biomécanique – Biomarqueurs de la motricité saine et altérée.
L’objectif des travaux développés dans l’axe Neuro-biomécanique est d’apporter une meilleure compréhension des mécanismes nerveux impliqués dans le contrôle du mouvement et l’apprentissage moteur.
A travers une approche pluridisciplinaire aux interfaces entre recherche fondamentale, clinique et translationnelle, nous explorons les fonctions cognitives et motrices et les mécanismes nerveux spinaux et supra-spinaux sous-jacents impliqués dans le contrôle des contractions musculaires saines ou altérées, chez des individus sains, des experts et des patients neurologiques.
Nos thématiques de recherche :
— Approche multidimensionnelle des cocontractions spastiques chez le sujet cérébrolésé | Portée par David GASQ
— Mécanismes nerveux impliqués dans la flexibilité émotionnelle du contrôle moteur | Portée par Lilian FAUTRELLE
— Mécanismes nerveux spinaux et supra-spinaux impliqués dans le contrôle de l’activité musculaire | Portée par David AMARANTINI & Julien DUCLAY
— Rôle du rythme dans l’apprentissage moteur et la réadaptation chez des enfants présentant des troubles moteurs | Portée par Jessica TALLET
— Troubles de la motricité dans les pathologies neuro-développementales | Portée par Evelyne BLOCH-GALLEGO
L’imagerie clinique
Troubles de la coordination et connectivité cérébrale en Electroencéphalographie
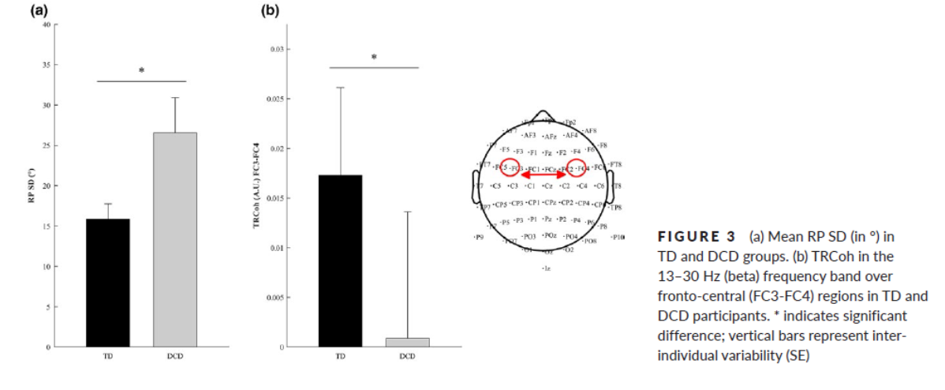
Jessica Tallet et ses collègues ont enregistré l’EEG chez des enfants présentant des troubles de la coordination du développement (DCD) et des témoins avec un développement typique (TD). Ils ont démontré que la communication interhémisphérique atypique est en corrélation avec une inhibition motrice modifiée lors de l’apprentissage d’un nouveau modèle de coordination bimanuelle dans le trouble de la coordination du développement. En effet, un contrôle moteur approprié implique l’inhibition des mouvements du miroir, qui repose sur la connectivité et la cohérence inter-hémisphériques (RP : phase relative ; TRCOh : cohérence liée à la tâche) (Blais et al., Developmental Science, 2018).
AVC et Connectivité fonctionnelle en IRM
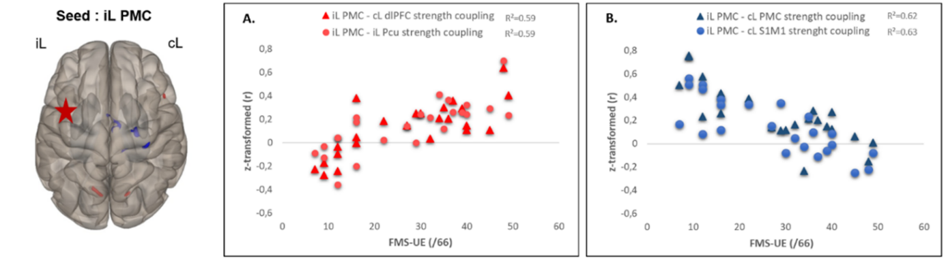
La connectivité fonctionnelle en IRM pendant une tâche sensorimotrice a été étudiée chez 25 patients ayant subi un AVC et a été corrélée au déficit moteur (échelle de Fugl-Meyer du membre supérieur, FMS-UE). Une connectivité négative du cortex prémoteur ipsilésionnel avec les régions motrices controlésionnelles (en bleu) est observée chez les patients très déficitaires et met en évidence une déconnexion. Une connectivité fonctionnelle intermodale du cortex prémoteur ipsilésionnel avec des régions non motrices (cortex préfrontal, précuneus) a été mis en evidence et peut refléter des stratégies de compensation intermodales efficaces (en rouge) (Brihmat et al., Brain Connectivity 2020).
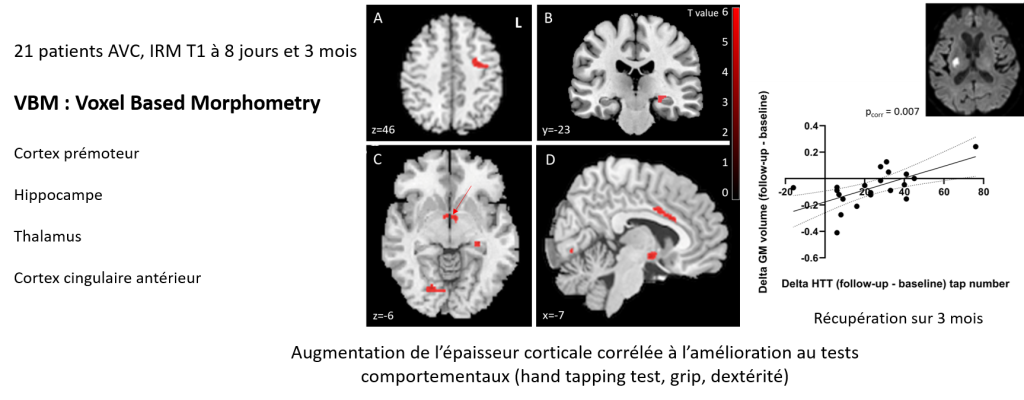
AVC et Plasticité Cérébrale en IRM multimodale
La plasticité cérébrale a été explorée chez 21 patients avec une lésion capsulaire et un déficit moteur pur à 4 jours (SD 3) post-AVC et à 4 mois. La fraction d’anisotropie du faisceau corticospinal (FACST) était significativement réduite du côté lésé à 4 mois et corrélée aux performances motrices (test des 9 chevilles , dynamomètre, test du ‘tapping’). La FACST est donc un bon biomarqueur diagnostiquant les déficits moteurs post-AVC. La technique de ‘Voxel Based Morphometry’ (VBM) a révélé des augmentations d’épaisseur corticale dans plusieurs régions qui corrélait avec les performances. La présence de tractus moteurs alternatifs n’était pas corrélée avec la récupération. Dans ce groupe de patients peu déficitaires, il semblerait donc qu’une bonne récupération repose sur des fibres corticospinales préservées en particulier le cortex prémoteur ipsilésionnel. VBM et la FACST seraient des biomarqueurs fiables de l’atrophie, de la réorganisation, de la plasticité et de la récupération post-AVC (Loubinoux et al., J Neurol 2024).