Recherche translationnelle en santé,
technologie pour la santé et recherche clinique
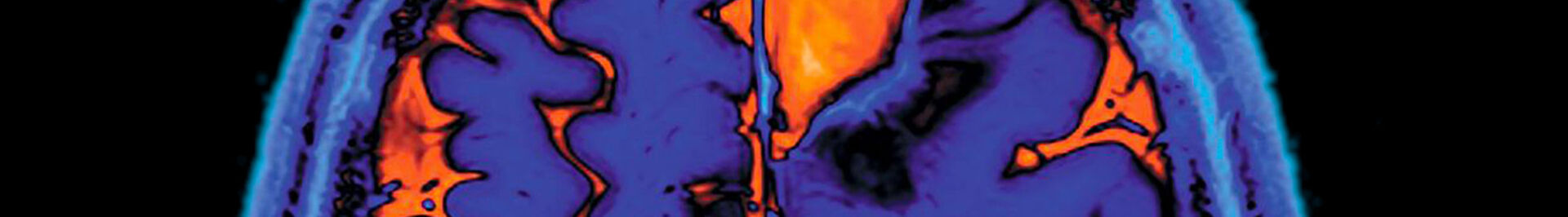
DEVIN / Axe 2 : Développement de biomarqueurs en médecine nucléaire
Projets
Principes généraux du développement de radiotraceurs
Réalisations et projets sur les radiotraceurs du récepteur NMDA
Labex Iron, FEDER/Région Occitanie
Coordinateur : P. Payoux
Membres DEVIN impliqués dans le projet: AS Salabert, M Beaurain, P Payoux
Membre du plateau technique PiR2 : N Packer , FX dubrulle
Partenaire 1 : LABEX IRON
Partenaire 2: Franck Talmont ( IR IPBS Toulouse)
Partenaire 3 : Emmanuel Gras , Mathieu Danel ( LHFA Toulouse)
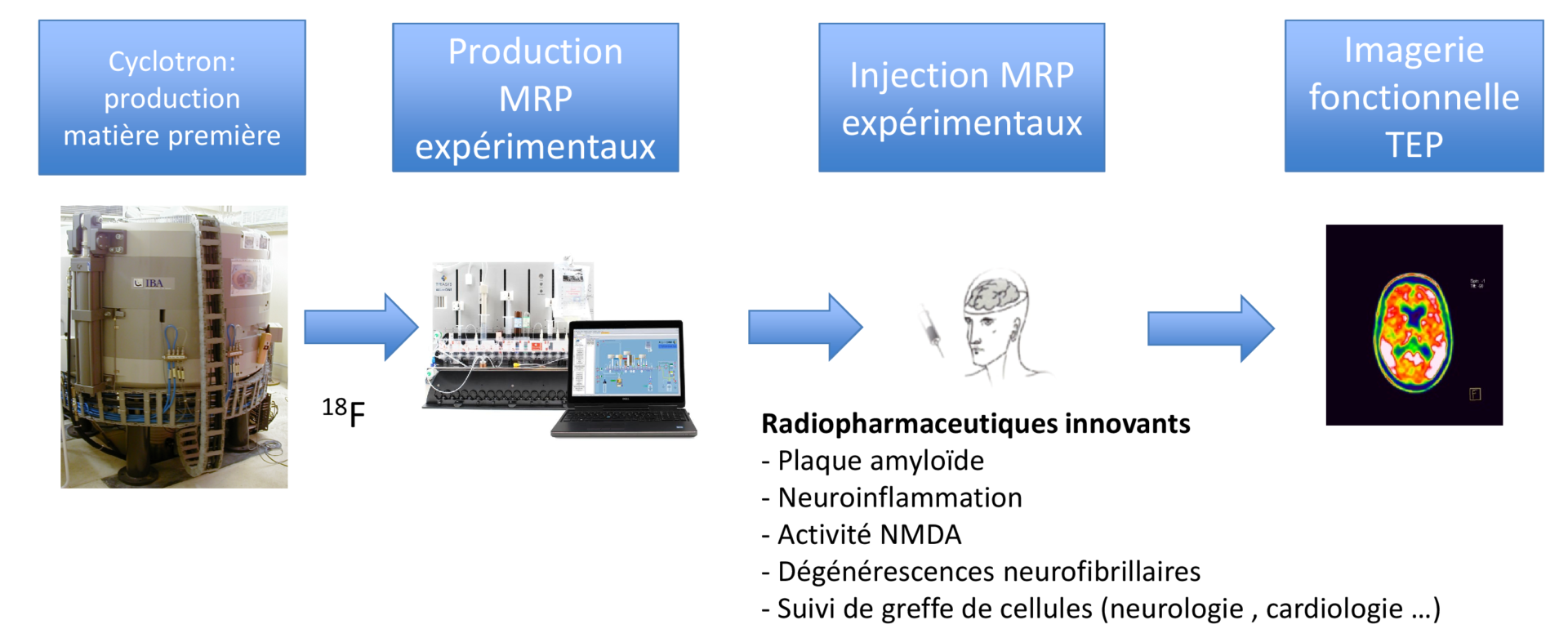
Les récepteurs NMDA sont des récepteurs au glutamate fortement impliqués dans la plasticité cérébrale et dans les phénomènes d’apprentissage et de mémoire. Ils possèdent deux types de localisations : NMDAR localisés sur la synapse et qui jouent un rôle dans la plasticité à long terme et NMDAR extra synaptiques qui lors d’une excitation trop intense engendreraient des phénomènes d’apoptose. Une étude récente a établi le rôle sélectif des NMDARs extra-synaptiques dans l’émergence des précurseurs de la MA. Il semble en effet que l’entrée de calcium par ces récepteurs, mais pas par ceux localisés à la synapse, provoque une dérégulation du métabolisme des APP. La mémantine est un antagoniste des récepteurs NMDA et principalement des récepteurs extrasynaptiques. C’est un antagoniste canal qui s’intègre au centre du récepteur en le bloquant quand celui-ci est ouvert. Cette propriété en fait donc un vecteur d’imagerie intéressant pour étudier l’hyperactivation présumée des récepteurs NMDA extrasynaptiques dans le vieillissement et dans la MA. Un traceur fluoré dérivé de la mémantine développé par notre équipe a été synthétisé : la [18F]-Fluoroéthylnormémantine ([18F]FNM). Nous avons montré que ce radiotraceur passait la barrière hémato encéphalique et que sa localisation cérébrale correspondait à celle des récepteurs NMDA. La spécificité de ce traceur a été étudiée par comparaison de la fixation du radiotraceur avec un animal contrôle (récepteur saturé avec un antagoniste NMDA : kétamine) et a montré que le traceur était bien spécifique du récepteur NMDA.
Ces études ont été réalisées ex vivo, et ont été revalidées in vivo par imagerie microTEP au sein de la plateforme petit animal.
L’évaluation de la pharmacocinétique d’un médicament radiopharmaceutique est une étape importante de la validation de son intérêt pour le diagnostic: les phases de distribution, de métabolisation et d’élimination sont des données nécessaires à la meilleure compréhension du comportement du radioligand. Des différences inter-espèce concernant la métabolisation et la prise en charge par les protéines de transport ou d’efflux existe pour de nombreux composés c’est pourquoi il est intéressant de procéder à une étude sur deux espèces (rongeur et primate non humain). L’imagerie microTEP est la technique de choix permettant d’évaluer le passage de la barrière hématoencéphalique pour chaque espèce et de déterminer le temps optimal pour imager l’animal, elle permet d’établir une courbe qui décrit l’activité du radiotraceur en fonction du temps par organe étudié. Nous avons réalisé cette imagerie chez le rat et chez le marmouset. L’étude des Courbes activité temps a permis de réaliser une estimation de la dose reçue par l’animal et a permis une extrapolation de cette dose chez l’homme.
Les études précédentes ont été réalisées sur des animaux sains afin de déterminer les caractéristiques du radiotraceurs. Nous avons ensuite procédé à des études sur des modèles d’animaux pathologiques.
La création d’un modèle lésionnel comportant une hyperactivation des NMDA a permis de tester la capacité de la [18F] FNM à discriminer une zone d’hyperactivation d’une zone normale. Ce modèle a été réalisé sur des rats qui ont subit une injection intracérébrale d’excitotoxines agonistes du glutamate, provoquant une suractivation des récepteurs au glutamate et spécifiquement du récepteur NMDA. Cette expérimentation nous a permis d’évaluer la capacité du radiotraceur à discriminer une hyperactivation des récepteurs NMDA par comparaison de l’hémisphère sain et de l‘hémisphère lésé.
Nous avons pu ainsi visualiser la cinétique des activations de récepteurs NMDA après lésion (J0, J+1, J+3, J+5). Grâce au traitement d’image et à l’analyse voxel à voxel sur le logiciel spm , nous avons fait un « template » de cerveaux de rats sain et nous avons pu comparer les rats lésés à ce template. Nous avons pu constater que l’on pouvait discerné la zone lésée avec la FMN mais que les zones hyperactives évoluent avec le temps avec une activation importante de la zone perilesionnelles précoce et une activation de zones en réseaux avec la zone lésé plus tardive.
Les expérimentations sur les rats lésées sont achevées. Elles ont donné lieu a un poster à l’ECCN 2018 (Exploration of glutamatergic system activation by [18F]FNM in PET ) et un article est en cours de rédaction.
Grâce aux données sur les animaux sains,un dossier de médicament expérimental pour cette molécule ( DME1 et 2) a été rédigé et nous avons obtenu l’autorisation de l’utiliser chez l’humain.
Nous avons obtenu des financements pour utiliser cette molécule dans une étude sur la maladie de Gille de la Tourette ( protocole Glutatour) et nous avons réalisé la première image sur un patient atteint de la maladie en janvier 2019.
, nous travaillons également sur la mise au point d’un ligand plus affin pour les récepteurs NMDA. Grâce à une collaboration avec deux laboratoires toulousains ( LCC et IPBS) , nous sommes en train de réaliser des études de binding afin de sélectionner les dérivés de mémantine, d’ifenprodil et de diarylguanine les plus afins pour le récepteur NMDA.
—
Réalisation et projet sur le suivi d’une thérapie cellulaire post AVC grâce à l’imagerie moléculaire
Ce projet est en partenariat avec l’équipe iDREAM.
Objectifs:
La greffe de cellules souches constitue une thérapie innovante notamment en neurologie, il est nécessaire de développer des outils permettant le suivi in vivo de ces cellules après greffe. L’imagerie moléculaire peut répondre à cette problématique : grâce à des techniques de biologie, les futures cellules greffées peuvent être modifiées génétiquement avec un gène codant pour la thymidine kinase HSV1-tk. Nous utiliserons ensuite un radioligand substrat de cette enzyme, la 9-(4-[18F]Fluoro-3-hydroxymethylbutyl)guanine ([18F]-FHBG), pour visualiser les cellules. Lorsqu’une cellule exprime l’HSV1-tk, la [18F]-FHBG est phosphorylée et s’y s’accumule. Nous avons développé cet outil dans notre centre et nous avons étudié sa captation in vitro et in vivo.
Nous avons mis en place une radiosynthèse automatisée de la [18F]-FHBG . Il s’agit d’une substitution nucléophile d’un groupe tosylate par un atome de 18F suivie d’une étape d’hydrolyse acide. Un rendement optimal de synthèse (11,69%) a été obtenu à une température de substitution nucléophile de 110°C. Le solvant d’élution utilisé est un mélange d’acétate de sodium et d’éthanol (90:10) compatible avec une mise en contact avec les cellules ainsi qu’avec une injection in vivo. L’activité spécifique est supérieure à 3,2 GBq/µmoles, et l’activité moyenne synthétisée est de 1850 MBq. Le log D est de -0,88, la molécule est donc hydrophile.
La transfection a d’abord été mise au point sur des cellules neuro2a avec un plasmide contenant le gène de la TK et un gène de résistance à la néomycine permettant leur sélection. Nous avons ensuite mesuré le pourcentage de [18F]-FHBG capté par ces cellules et nous l’avons comparé à la captation par des cellules non transfectées. Le pourcentage de captation des cellules transfectées est 10 fois supérieur à celui des cellules non transfectées. Nous avons réalisé une calibration in vivo : les cellules incubées dans le radiotraceur sont injectées de manière stéréotaxique dans les cerveaux de rats préalablement lésés. Les rats sont lésés à l’aide d’une toxine (Malonate 3M) injectée au niveau du cortex moteur à 2 mm de profondeur (coordonnées 2 mm latéral, 0 mm antérieur atlas de Paxinos). Nous avons pu ainsi suivre la qualité des injections et nous avons corrélé le nombre de cellules injectées avec l’intensité du signal émis en TEP.

Marie BEAURAIN

Laurent GUILLON

Pierre PAYOUX

Isabelle QUELVEN

